2021年11月25日,国家药监局附条件批准亚盛医药全资子公司顺健生物研发的三代ABL抑制剂奥瑞巴替尼(GZD824,HQP1351)上市,用于治疗任何酪氨酸激酶抑制剂耐药,并采用经充分验证的检测方法诊断为伴有T315I突变的慢性髓细胞白血病慢性期或加速期的成年患者。奥瑞巴替尼(GZD824,HQP1351)是全球第二个、中国第一个上市的第三代BCR-ABL抑制剂,也是亚盛医药的首款获批上市新药。
奥瑞巴替尼,既往使用编号为GZD824,HQP1351等,是亚盛医药开发的一款口服第三代BCR-ABL抑制剂,为亚盛医药的核心品种。先后被中国药监局纳入优先审评和突破性治疗品种,也被美国FDA授予快速通道资格及孤儿药资格。该产品对BCR-ABL以及包括T315I突变在内的多种BCR-ABL突变体有效,能够克服一二代ABL抑制剂的临床耐药问题。
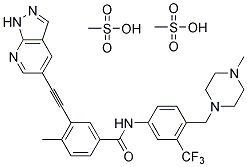
奥瑞巴替尼(HQP1351,GZD824)
慢性髓系白血病(CML)是一种骨髓造血干细胞异常的恶性肿瘤,费城染色体或BCR-ABL融合蛋白的表达是其主要发病机制。一代BCR-ABL抑制剂及后续推出的几种二代药物对CML的治疗具有显著的临床效益,但靶蛋白突变介导的获得性耐药一直是CML治疗的主要挑战。BCR-ABL-T315I突变是常见的耐药突变类型之一,在耐药CML中的发生率高达25%左右,目前上市的一二代ABL抑制剂对其均无效。唯一上市三代ABL抑制剂帕纳替尼虽然对T315I突变耐药有效,但血栓等副作用限制了其临床应用,该药物被FDA黑框警告,并且没有进入中国市场。因此,瑞巴替尼(GZD824,HQP1351)的上市将极大缓解T315I突变耐药CML患者的临床治疗。
临床研究数据
奥雷巴替尼临床拟使用方式为40 mg口服、隔天给药、28天为一个周期。据亚盛医药披露的开放性、单臂、多中心II期临床研究结果:
• 截至2020年8月25日,HQP1351-CC201共入组41例CML-CP患者,其中32例(78%)完成了≥12个周期,中位随访时间为13(3.1-16.3)个月。基线时没有反应的受试者在≥12个治疗周期后,CHR达到100%。MCyR为75.6%(31/41),CCyR率为68.3%(28/41),MMR为56.1%(23/41)。受试者在第12个月的PFS率为89.3%, 总生存(OS)率为100%。
• 截至2020年7月27日,HQP1351-CC202共入组23例CML-AP患者,其中14例(61%)完成了≥12个周期,中位随访时间为13.5(1.4-15.2)个月。基线时没有反应的受试者在≥12个治疗周期后,血液学深度缓解率(MaHR)达到73.9%(17/23),MCyR为52.2%(12/23),CCyR为47.8%%(11/23),MMR为39.1%(9/23)。受试者在第12个月的PFS率为74.1%, OS率为91.3%。
• 在HQP1351-CC201中最常见的3级/4级治疗相关不良反应(TRAE)是血小板减少(48.8%),没有治疗相关性死亡发生。
• 在HQP1351-CC202中最常见的3级/4级TRAE是血小板减少(56.5%)。
2008年,立项。
2011年1月9日,中国科学院广州生物医药与健康研究院组建的艾比克创业团队的"抗白血病1类新药DP605(即GZD824)的临床前研究项目"获得中科院第四界青年创业大赛唯一金奖;
2013年3月21日,中国科学院广州生物医药与健康研究院官网披露了GZD824的临床前数据:
-
中科院广州生物医药与健康研究院丁克博士带领团队经过近4年的技术攻关,成功设计和合成了芳基炔类和三氮唑苯甲酰胺两类Bcr-Abl小分子抑制剂。化合物在多种激酶、细胞和动物模型中可有效克服Bcr-AblT315I突变诱发的耐药问题。
-
化合物GZD824可以以pM的IC50值抑制Bcr-AblWT及Bcr-AblT315I等耐药突变体的激酶活性(分别为0.34和0.68 nM),并对P-loop区突变(E255K/V)等有效。化合物在多种细胞和动物模型中表现出优异抗肿瘤活性(针对K562,Ku812等CML肿瘤细胞的IC50为0.2~10 nM;针对携带Bcr-AblT315I 突变体的Ba/F3细胞的IC50约为7 nM;在1.0-20.0 mg/kg/day 的口服剂量下完全抑制肿瘤生长)和较好的安全性指标及优异的药代动力学性质(大鼠口服生物利用度约为48.7%;体内半衰期T1/2约为8-10小时)。
-
目前,GZD824已被确定为候选药物,正在进行规范的临床前评价。以该项目为基础,研究团队还获得2011年“第四届中国科学院青年创业大赛”金奖。
-
该项研究获得国家新药创制重大专项、广东省新药创制重大专项、广州市重大专项以及中科院交叉团队项目等资助。部分结果已在药物化学期刊J. Med. Chem. 发表[J. Med. Chem. 2013, 56(3), 879-894;J. Med. Chem. 2012, 55 (22), 10033-10046]。
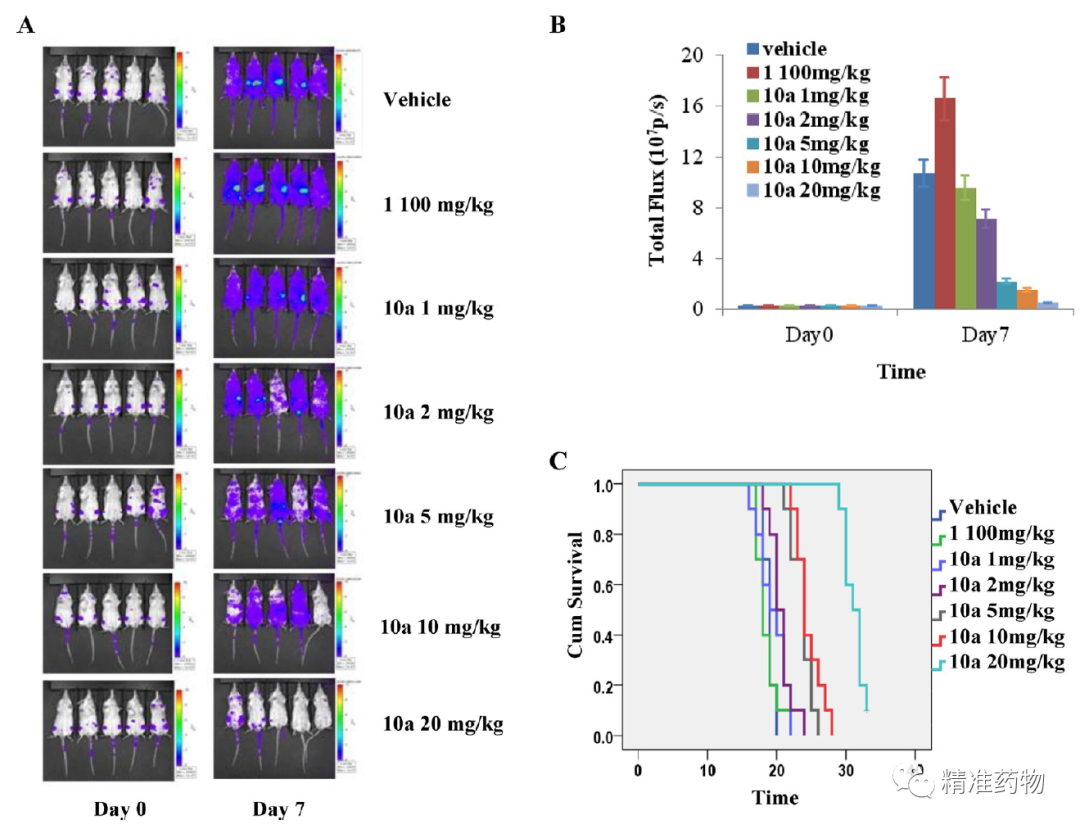
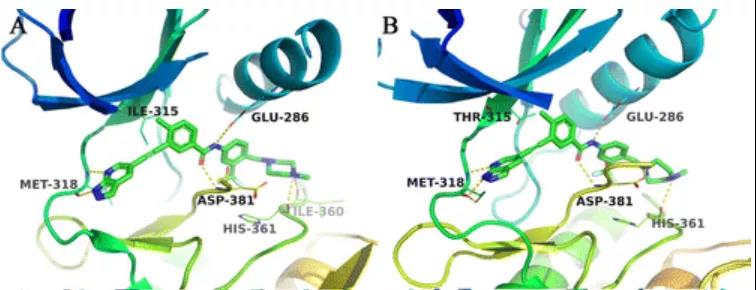
HQP1351(GZD824,10a)体内克服T315I耐药 (来源:JMC, 2013, 56(3):879-894.)
2013年,GZD824转让给广州顺健生物医药科技有限公司,更名为HQP1351进行后期开发。
2015年4月,亚盛向CFDA提交HQP1351用于治疗耐药性CML患者的IND。
2016年 2月,HQP1351获得临床批准,并于当年启动I期临床试验。
2018年8月,亚盛向CDE汇报了I期结果,并积极沟通Ⅱ期方案。
2018年12月,HQP1351的Ⅱ期临床方案获得通过,并获准在完成Ⅱ期试验后即可提交新药上市申请(NDA)。
2019年8月,完成治疗AP-CML患者的临床试验的招募;9月,启动CP-CML的招募(招股书信息)。
2018年12月3日,江倩教授在2018 ASH会场口头报告了HQP1351的中国I临床临床研究进展:
-
HQP1351治疗对TKI耐药的CML患者的Ⅰ期临床试验在中国开展,共入组11个剂量组(1mg递增到60mg);
-
截止到2018年10月底,该项研究共入组100例CML患者(86例CP患者, 14例AP患者);
-
HQP1351在除60mg剂量组外的所有剂量组均耐受良好。没有患者因为治疗相关的不良事件(TRAEs)而退出研究。
-
60mg剂量组的3例患者中2例出现剂量限制毒性(DLT),50mg 被认为是最大耐受剂量(MTD);在可评估病例中,CP病人完全血液学缓解(CHR)率为96%,AP病人CHR率为85%;
-
在66例可评估CP病例中,主要细胞遗传学缓解(MCyR)率为67%。特别是在带有T315I突变的CP病例中,MCyR率高达78%。
2019年5月27日,亚盛医药招股书披露了HQP1351的I期临床研究数据(101 名患者当中有92 人仍然在接受治疗,最长治疗期限为31个月):
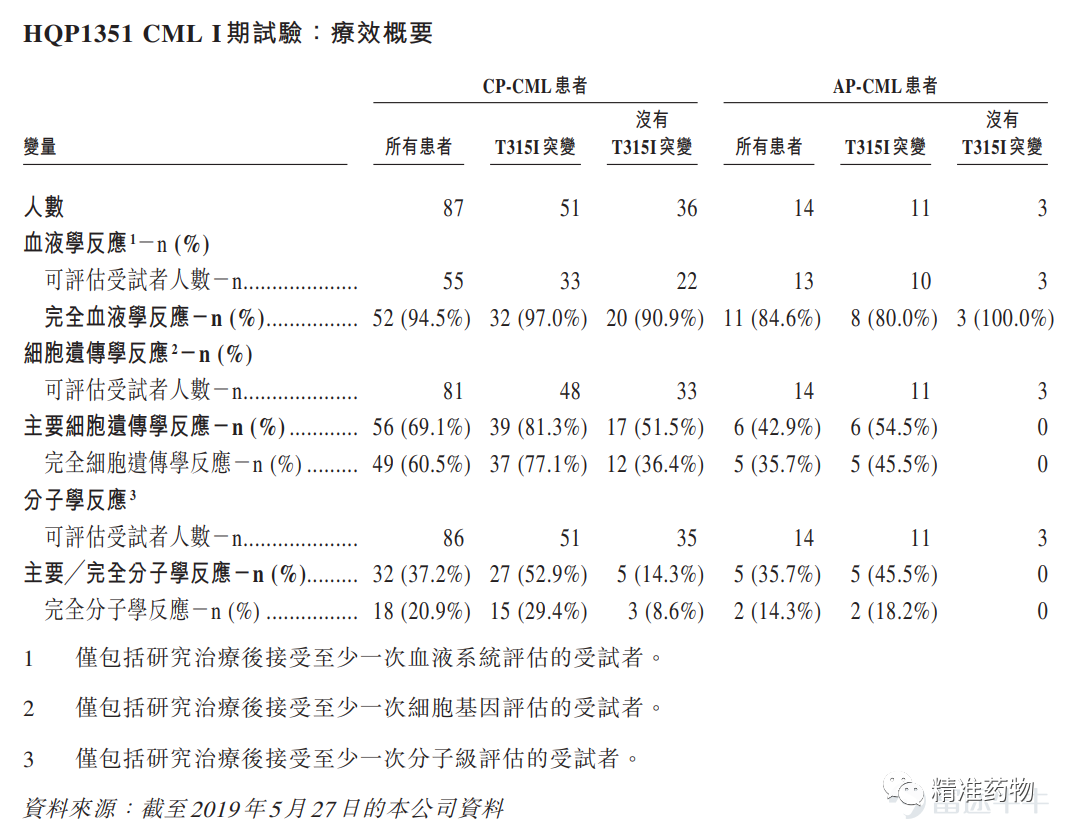
亚盛医药招股书资料
2019年7月22日,亚盛医药宣布,HQP1351获准在美国进行临床Ib试验,用于治疗针对TKI(酪氨酸激酶抑制剂)耐药的慢性髓性白血病(CML)。
2019年12月11日,亚盛医药宣布,该项临床研究的主要研究者、北京大学人民医院血液科副主任江倩教授为报告人在第61届美国血液学会(American Society of Hematology,ASH)年会上再次以口头报告的形式公布了HQP1351的I期临床进展数据,该研究获得本届ASH年会“最佳研究”(Best of ASH)提名。数据显示:
-
HQP1351针对TKI耐药的CML慢性期(CP)或加速期(AP)患者的I 期临床试验在中国开展,共入组11个剂量组(1mg递增到60mg),最终确定60mg QOD为剂量限制性毒性(DLT)剂量, 50mg QOD为最大耐受剂量(MTD),40mg QOD为II期临床推荐用药量(RP2D)。
-
截止到2019年5月27日,该项研究共入组101例CML患者(87例CP患者, 14例AP患者),中位随访时间为12.8个月(1.2~31.5)。CP患者的18个月无进展生存率(PFS)为94%,AP患者为61%。
-
HQP1351在除60mg剂量组外的所有剂量组均耐受良好。治疗相关不良反应(TRAE)中,大多数非血液学不良反应是1级或2级,最常见的3级/4级血液学TRAE是血小板减少(50%)。TRAE 的发生率随治疗时间延长而降低。没有治疗相关性死亡或5级不良事件发生。
-
HQP1351对CML患者显示出有效的抗白血病活性,治疗患者获得了较高的反应率。且随着治疗时间的延长,缓解率和缓解深度都会增加。所有可评估患者中,CP患者的完全血液学缓解(CHR)率为95%, AP患者的CHR率为85%。
-
在95例可评估的基线非完全遗传学缓解(non-CCyR)患者中,CP患者主要细胞遗传学反应(MCyR)率为69%,其中61%获得了完全细胞遗传学反应(CCyR);AP患者MCyR率为43%,其中36%获得CCyR。
-
可评估患者中,37%的CP患者和36%的AP患者达到主要分子生物学缓解(MMR)。
-
在伴有高度耐药的T315I突变的患者中,HQP1351显示了卓越的疗效。在CP伴有T315I的患者中,MCyR率达到了82%,其中CCyR率高达78%。
2019年12月公开信息显示,HQP1351已在中国启动针对GIST患者的Ib期临床试验。同时在美国的临床Ib期研究也已启动。
2020年5月4日,亚盛医药宣布,美国食品和药品监督管理局(FDA)已授予公司核心在研品种HQP1351孤儿药资格认定,用于治疗慢性髓性白血病(CML)。
2020年5月7日,亚盛医药5月7日宣布,美国食品和药品监督管理局(FDA)已授予公司核心在研品种HQP1351快速通道资格(FTD),用于治疗对现有酪氨酸激酶抑制剂(TKI)治疗失败的特定基因突变的慢性髓性白血病(CML)患者。
2020年6月18日,亚盛医药宣布已经向NMPA提交HQP1351的上市申请。
2020年9 月 29 日,亚盛药业首次对外公布HQP1351的中文通用名为奥瑞巴替尼片。
2020年10月21日,亚盛医药宣布,该公司全资子公司顺健生物的1类新药奥瑞巴替尼片(HQP1351的拟定中文通用名)已正式被中国家药品监督管理局新药审评中心(CDE)纳入优先审评。
2021年11月12日,NMPA官网公示,奥瑞巴替尼(GZD824,HQP1351)新药上市申请的审评审批状态已更新为“在审批“。
2021年11月25日,NMPA批准奥瑞巴替尼(GZD824,HQP1351)上市申请。
参考资料:
1)http://sq.nmpa.gov.cn/datasearch_nmpa/schedule/search.jsp?tableId=43&tableName=TABLE43&columnName=COLUMN464,COLUMN475&title1=药品注册进度查询
2 https://www.ascentagepharma.com/news/press-releases/
3)https://www.ascentagepharma.com/news/press-releases/
4)J Med Chem. 2013 Feb 14;56(3):879-94. doi: 10.1021/jm301581y.